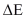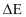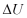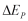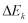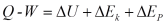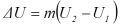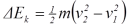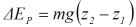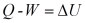HUKUM TERMODINAMIKA II
Hukum termodinamika pertama menyatakan bahwa energi adalah kekal. Bagaimanapun, ada banyak proses yang bisa kita bayangkan yang merubah energi tetapi tidak tampak terjadi di alam. Sebagai contoh, ketika sebuah benda yang panas diletakkan bersentuhan dengan benda yang dingin, kalor mengalir dari yang panas ke yang dingin, tidak pernah sebaliknya secara spontan. Jika kalor meninggalkan benda yang dingin dan masuk ke yang panas, energi akan tetap bisa kekal. Tetapi proses ini tidak berlangsung secara spontan (tanpa masukan kerja dalam bentuk apapun). Sebagai contoh kedua, pertimbangkan apa yang terjadi ketika anda menjatuhkan batu dan menimpa tanah. Energi potensial awal batu berubah menjadi energi kinetik pada saat batu jatuh, dan ketika batu tersebut mengenai tanah, energi ini diubah menjadi energi dalam dari batu tersebut dan tanah di sekitar tempat jatuhnya; molekul-molekul bergerak dengan lebih cepat dan temperatur sedikit naik. Tetapi pernahkah Anda melihat yang sebaliknya-sebuah batu dalam keadaan diam di tanah tiba-tiba naik ke udara karena energi termal molekul diubah menjadi energi kinetik batu sebagai satu kesatuan? Energi dapat kekal pada proses ini, tetapi kita tidak pernah melihatnya terjadi.
Hukum termodinamika pertama menyatakan bahwa energi adalah kekal. Bagaimanapun, ada banyak proses yang bisa kita bayangkan yang merubah energi tetapi tidak tampak terjadi di alam. Sebagai contoh, ketika sebuah benda yang panas diletakkan bersentuhan dengan benda yang dingin, kalor mengalir dari yang panas ke yang dingin, tidak pernah sebaliknya secara spontan. Jika kalor meninggalkan benda yang dingin dan masuk ke yang panas, energi akan tetap bisa kekal. Tetapi proses ini tidak berlangsung secara spontan (tanpa masukan kerja dalam bentuk apapun). Sebagai contoh kedua, pertimbangkan apa yang terjadi ketika anda menjatuhkan batu dan menimpa tanah. Energi potensial awal batu berubah menjadi energi kinetik pada saat batu jatuh, dan ketika batu tersebut mengenai tanah, energi ini diubah menjadi energi dalam dari batu tersebut dan tanah di sekitar tempat jatuhnya; molekul-molekul bergerak dengan lebih cepat dan temperatur sedikit naik. Tetapi pernahkah Anda melihat yang sebaliknya-sebuah batu dalam keadaan diam di tanah tiba-tiba naik ke udara karena energi termal molekul diubah menjadi energi kinetik batu sebagai satu kesatuan? Energi dapat kekal pada proses ini, tetapi kita tidak pernah melihatnya terjadi.
Ada banyak contoh lain dari proses yang terjadi di
alam tetapi kebalikannya tidak pernah terjadi. Ada dua contoh. (1) Jika Anda
meletakkan selapis garam disebuah botol dan menutupnya dengan selapis butuiran
merica yang ukurannya sama, ketika Anda mengocoknya, akan didapat campuran yang
sempurna. Tetapi tidak peduli seberapa lama Anda mengocoknya, campuran tersebut
tidak akan berpisah menjadi dua lapisan lagi. (2) Cangkir kopi dan gelas akan
pecah seketika jika Anda menjatuhkannya. Tetapi pecahannya tidak akan bersatu kembali
dengan seketika (gambar 8).
Pada Hukum termodinamika ke 2 Memberikan batasan-batasan terhadap perubahan energi.
Hukum Kekekalan Energi yang dinyatakan dalam Hukum I Termodinamika menyatakan
bahwa energi dapat diubah dari satu bentuk ke bentuk lain. Misalnya, perubahan
usaha (energi potensial) menjadi energi kalor atau sebaliknya. Akan tetapi,
tidak semua perubahan energi yang terjadi di alam ini prosesnya dapat dibalik
seperti pada Hukum I Termodinamika. Contoh, sebuah benda yang jatuh dari
ketinggian h sehingga menumbuk lantai. Pada peristiwa ini terjadi perubahan energi
kinetik menjadi energi kalor (panas) dan sebagian kecil menjadi energi bunyi.
Mungkinkah energi-energi kalor dapat berubah menjadi energi kinetik dan
menggerakkan benda setinggi h? Jelas bahwa hal ini akan terjadi, meskipun benda
kita panaskan terus-menerus.

Hukum II Termodinamika berbunyi “ panas mengalir secara spontan dari benda bersuhu tinggi menuju benda yang bersuhu lebih rendah, dan panas tidak dapat mengalir secara spontan dari benda bersuhu rendah menuju benda yang bersuhu lebih tinggi”.
Aplikasi dari hukum II Termodinamika ialah mesin carnot. Hukum II Termodinamika pada mesin Carnot berbunyi “ tidak mungkin untuk membuat sebuah mesin kalor yang cara kerjanya meyerap kalor dari reservoir bersuhu tinggi kemudian mengubah semua kalor tersebut menjadi usaha”. Dari pernyataan tersebut dapat disimpulkan tidak mungkin ada mesin carnot dengan efisiensi 100 %.
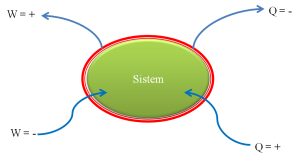
Perhatikan cara kerja mesin Carnot yang ditunjukkan oleh gambar 1 di atas. Kalor yang diterima (Q1) oleh mesin Carnot di ubah menjadi usaha (W) dan kalor sisanya akan dibuang (Q2).
Dari grafik yang ditunjukkan oleh gambar 1 kita dapatkan suatu persamaan
Efisisensi mesin Carnot merupakan perbandingan anatara usaha (W) yang dihasilkan dengan jumlah kalor secara keseluruhan. Efisiensi mesin Carnot dirumuskan :

Hukum II Termodinamika juga menyatakan bahwa” total entropi suatu semesta adalah konstan atau tetap jika berlangsung proses reversible dan total entropi suatu semesta akan bertambah jika berlangung proses irreversible”
Entropi merupakan total banyaknya kalor yang tidak diubah menjadi usaha oleh mesin carnot.





Hukum II Termodinamika diilhami oleh hukum I
Termodinamika. Masih ingatkah bagaimana bunyi hukum I termodinamika ? hukum I
Termodinamika merupakan hukum kekekalan energi, yang menyatakan enrgi bersifat
kekal artinya energi tidak dapat diciptakan dan energi tidak dapat dimusnahkan.
Menurut hukum kekekalan energi kita boleh mengubah energi panas menjadi bentuk
energi lain sesuka hati kita dengan syarat memenuhi hukum kekekalan energi
tersebut. Tetapi pada kenyataannya tidak demikian, kita tidak dapat mengubah
satu bentuk energi ke menjadi bentuk energi yang lain sesuka hati kita. Sebagai
contoh Jika anda menjatuhkan sebuah bola dari ketinggian tertentu. Sesaat
sebelum bola dijatuhkan, bola mempunyai energi potensial, ketika bola bergerak
ke bawah energi potensialnya berkurang dan energi kinetik bola bertambah.
Ketika bola menyentuh permukaan tanah energi potensial bola bernilai nol,
energi kinetik bola berubah menjadi energi panas dan energi bunyi. Sekarang
jika proses tersebut kita balik. Bola tersebut kita panaskan sehingga bola
mempuyai energi panas. Apakah energi panas tersebut dapat berubah menjadi
energi kinetik yang menyebabkan bola bergerak ke atas sampai pada ketinggian
tertentu sehingga bola mempunyai energi potensial ? hal tersebut tentu tidak
akan terjadi walau kita sudah memanaskan besi hingga suhu maksimum. Peristiwa
tersebut menunjukkan kepada kita bahwa proses
Hukum II Termodinamika berbunyi “ panas mengalir secara spontan dari benda bersuhu tinggi menuju benda yang bersuhu lebih rendah, dan panas tidak dapat mengalir secara spontan dari benda bersuhu rendah menuju benda yang bersuhu lebih tinggi”.
Aplikasi dari hukum II Termodinamika ialah mesin carnot. Hukum II Termodinamika pada mesin Carnot berbunyi “ tidak mungkin untuk membuat sebuah mesin kalor yang cara kerjanya meyerap kalor dari reservoir bersuhu tinggi kemudian mengubah semua kalor tersebut menjadi usaha”. Dari pernyataan tersebut dapat disimpulkan tidak mungkin ada mesin carnot dengan efisiensi 100 %.
Perhatikan cara kerja mesin Carnot yang ditunjukkan oleh gambar 1 di atas. Kalor yang diterima (Q1) oleh mesin Carnot di ubah menjadi usaha (W) dan kalor sisanya akan dibuang (Q2).
Dari grafik yang ditunjukkan oleh gambar 1 kita dapatkan suatu persamaan
Efisisensi mesin Carnot merupakan perbandingan anatara usaha (W) yang dihasilkan dengan jumlah kalor secara keseluruhan. Efisiensi mesin Carnot dirumuskan :

Hukum II Termodinamika juga menyatakan bahwa” total entropi suatu semesta adalah konstan atau tetap jika berlangsung proses reversible dan total entropi suatu semesta akan bertambah jika berlangung proses irreversible”
Entropi merupakan total banyaknya kalor yang tidak diubah menjadi usaha oleh mesin carnot.
Hukum II Termodinamika memberikan
batasan-batasan terhadap perubahan energi yang mungkin terjadi dengan beberapa
perumusan.
Tidak mungkin membuat mesin yang bekerja dalam satu
siklus, menerima kalor dari sebuah reservoir dan mengubah seluruhnya menjadi
energi atau usaha luas (Kelvin Planck).
Tidak mungkin membuat mesin yang bekerja dalam suatu
siklus mengambil kalor dari sebuah reservoir rendah dan memberikan pada
reservoir bersuhu tinggi tanpa memerlukan usaha dari luar (Clausius).
Pada proses reversibel, total entropi semesta tidak
berubah dan akan bertambah ketika terjadi proses irreversibel (Clausius).
Bunyi Hukum II Termodinamika
Untuk menjelaskan tidak adanya reversibilitas para
ilmuwan merumuskan prinsip baru, yaitu Hukum II Termodinamika, dengan
pernyataan : “kalor mengalir secara alami dari benda yang panas ke benda yang
dingin, kalor tidak akan mengalir secara spontan dari benda dingin ke benda
panas”.
Pengertian Entropi
Termodinamika menyatakan bahwa proses alami cenderung
bergerak menuju ke keadaan ketidakteraturan yang lebih besar. Ukuran
ketidakteraturan ini dikenal dengan sistem entropi. Entropi merupakan besaran
termodinamika yang menyerupai perubahan setiap keadaan, dari keadaan awal
hingga keadaan akhir sistem. Semakin tinggi entropi suatu sistem menunjukkan
sistem semakin tidak teratur. Entropi sama seperti halnya tekanan dan
temperatur, yang merupakan salah satu sifat dari sifat fisis yang dapat diukur
dari sebuah sistem. Apabila sejumlah kalor Q diberikan pada suatu sistem dengan
proses reversibel pada suhu konstan, maka besarnya perubahan entropi sistem
adalah
dengan:
ΔS = perubahan entropi ( J/K)
Q = kalor ( J)
T = suhu (K)
Q = kalor ( J)
T = suhu (K)
Mesin Pendingin
Mesin pendingin merupakan peralatan yang prinsip
kerjanya berkebalikan dengan mesin kalor. Pada mesin pendingin terjadi aliran
kalor dari reservoir bersuhu rendah ke reservoir bersuhu tinggi dengan
melakukan usaha pada sistem. Contohnya, pada lemari es (kulkas) dan pendingin
ruangan (AC). Bagan mesin pendingin dapat dilihat pada gambar berikut.
Bagan proses penyerapan kalor pada mesin pendingin
Ukuran kinerja mesin pendingin yang dinyatakan dengan
koefisien daya guna merupakan hasil bagi kalor yang dipindahkan dari reservoir
bersuhu rendah Q2 terhadap usaha yang dibutuhkan W.
dengan:
Kp = koefisien daya guna
W = usaha yang diperlukan ( J)
Q1 = kalor yang diberikan pada reservoir suhu tinggi ( J)
Q2 = kalor yang diserap pada reservoir suhu rendah ( J)
T1 = suhu pada reservoir bersuhu tinggi (K)
T2 = suhu pada reservoir bersuhu rendah (K)
W = usaha yang diperlukan ( J)
Q1 = kalor yang diberikan pada reservoir suhu tinggi ( J)
Q2 = kalor yang diserap pada reservoir suhu rendah ( J)
T1 = suhu pada reservoir bersuhu tinggi (K)
T2 = suhu pada reservoir bersuhu rendah (K)
Penerapan hukum II termodinamika dapat diamati pada
proses mengalirnya kalor pada mesin pemanas seperti ditunjukan pada gambar
berikut.
dengan:
Kp = koefisien daya guna
W = usaha yang diperlukan ( J)
Q1 = kalor yang diberikan pada reservoir suhu tinggi ( J)
Q2 = kalor yang diserap pada reservoir suhu rendah ( J)
T1 = suhu pada reservoir bersuhu tinggi (K)
T2 = suhu pada reservoir bersuhu rendah (K)
W = usaha yang diperlukan ( J)
Q1 = kalor yang diberikan pada reservoir suhu tinggi ( J)
Q2 = kalor yang diserap pada reservoir suhu rendah ( J)
T1 = suhu pada reservoir bersuhu tinggi (K)
T2 = suhu pada reservoir bersuhu rendah (K)
Penerapan hukum II termodinamika dapat diamati pada
proses mengalirnya kalor pada mesin pemanas seperti ditunjukan pada gambar
berikut.













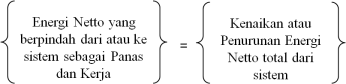 (8)
(8)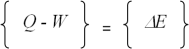 (9)
(9)