<


Suatu sistem (system)
didefinisikan sebagai sesuatu yang harus di cermat dan juga di kaji lebh dalam
lagi. Daerah di luar sistem disebut lingkungan (surrounding), sedangkan batas
antara sistem dan lingkungan disebut batas sistem (system boundary). Sistem
dapat dibedakan menjadi sistem tertutup (close system) dan sistem terbuka (open
system). Pada kuliah ke 3 di Universitas Sriwijaya tepatnya di Palembang ini,
pada pertemuan ke 3 kami mempelajari tentang Sistem tertutup termodinamika atau
Mass Energy and Analysis of Volume Controles.
Sistem
tertutup atau biasa dikenal sebagai kontrol massa, terdiri dari sejumlah massa
dan tidak ada massa yang melewati batas sistem (system boundary). Meskipun
tidak ada perpindahan massa yang masuk dan keluar sistem, tetapi panas atau
kerja masih dapat keluar-masuk sistem. Apabila terdapat kondisi sistem tertutup
yang tidak mengijinkan energi atau panas untuk keluar-masuk sistem, sistem itu
disebut sistem terisolasi (isolated system). Contoh dari sistem tertutup adalah
piston pada sepeda motor.
Moving Boundary bekerja dengan mesin atau kompresor sesungguhnya tidak bisa ditentukan secara tepat dari analisis termodinamika saja karena piston biasanya bergerak dengan kecepatan sangat tinggi, sehingga menyulitkan gas di dalam untuk menjaga keseimbangan. Kemudian bagian yang dapat melalui dimana sistem dapat melewati selama proses tidak dapat di tentukan, dan tidak ada jalur proses yang dapat dilakukan yang belum di putuskan. alat Bekerja, menjadi fungsi yang di putuskan tidak bisa ditentukan secara analitis tanpa sebuah pengetahuan tentang putusan itu. Karena itu, batas pekerjaan di mesin nyata atau kompresor ditentukan dengan pengukuran langsung. Pada bagian ini, kita menganalisis kerja batas bergerak
Perhatikan gas yang tertutup dalam perangkat silinder
piston yang ditunjukkan. Tekanan awal gas adalah P, total volume adalah V,
dan luas penampang piston adalah A. Jika piston diperbolehkan memindahkan jarak
ds dengan cara kuasi-ekuilibrium, kerja diferensial yang dilakukan selama
proses ini adalah:

Contoh Soal Moving Boundary

Pada sistem tertutup
juga terjadi pertukaran energi (panas dan kerja) tetapi tidak terjadi pertukaran
benda dengan lingkungan. Dalam sistem tertutup masa dari sistem yang dianalisis
tetap dan tidak ada
masa keluar dari sistem atau masuk kedalam sistem, tetapi volumenya bisa berubah. Yang dapatkeluar masuk sistem tertutup adalah energi dalam bentuk panas atau kerja. Contoh sistem tertutup
adalah suatu balon udara yang dipanaskan, dimana masa udara didalam balon tetap, tetapi volumenya
berubah, dan energi panas masuk kedalam masa udara didalam balon. Selain itu Rumah hijau adalah
contoh dari sistem tertutup di mana terjadi pertukaran panas tetapi tidak terjadi pertukaran kerja
dengan lingkungan.
masa keluar dari sistem atau masuk kedalam sistem, tetapi volumenya bisa berubah. Yang dapatkeluar masuk sistem tertutup adalah energi dalam bentuk panas atau kerja. Contoh sistem tertutup
adalah suatu balon udara yang dipanaskan, dimana masa udara didalam balon tetap, tetapi volumenya
berubah, dan energi panas masuk kedalam masa udara didalam balon. Selain itu Rumah hijau adalah
contoh dari sistem tertutup di mana terjadi pertukaran panas tetapi tidak terjadi pertukaran kerja
dengan lingkungan.
Sebagaimana gambar sistem tertutup dibawah ini, jika panas diberikan
kepada sistem (Qin), maka akan terjadi pengembangan pada zat yang berada didalam
sistem. Pengembangan ini akan mengakibatkan piston akan terdorong ke atas
(terjadi Wout). Karena sistem ini tidak mengizinkan adanya keluar masuk massa
kedalam sistem (massa selalu konstan) maka sistem ini disebut dengan control
mass.
Suatu sistem bisa mengalami pertukaran panas atau kerja atau keduanya,
biasanya dipertimbangkan sebagai sifat pembatasnya:
- Pembatas adiabatik: tidak memperbolehkan
pertukaran panas.
- Pembatas rigid: tidak memperbolehkan
pertukaran kerja.
Dikenal juga istilah dinding, ada dua jenis dinding yaitu dinding adiabatik
dan dinding diatermik. Dinding adiabatik yaitu dinding yang
menyababkan kedua zat mencapai suhu yang sama dalam waktu yang lama
(lambat). Untuk dinding adiabatik sempurna tidak memungkinkan terjadinya suatu
pertukaran kalor antara dua zat. Sedangkan dinding diatermik yaitu dinding
yang memungkinkan kedua zat mencapai suhu yang sama dalam waktu yang singkat
(cepat)

Persamaan ini dapat pula disebut Hukum Termodinamika I
untuk sistem tertutup.
Hukum I Thermodinamika menerangkan tentang
prinsip konservasi energi yang menyatakan bahwa, energi tidak dapat diciptakan
dan dimusnahkan, namun demikian energi tersebut dapat diubah dari satu bentuk
ke bentuk yang lain menjadi kerja misalnya. Dari konsep ini, dapat
dikatakan bahwa energi dapat diubah menjadi kerja dan juga kerja dapat diubah
menjadi energi. Dalam kaitan dengan Thermodinamika salah satu bentuk dari
energi yang dimaksud adalah Panas (Heat), dan kerja (Work).
Ditinjau suatu sistem tertutup, persamaan
energi di peroleh dari penyusunan Neraca Energi untuk sistem tertutup tersebut,
yaitu seperti berikut :
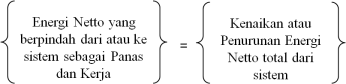 (8)
(8)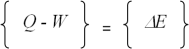 (9)
(9)
Keterangan : Q
= Panas yang berpindah dari atau ke sistem ( Qin – Qout )
W
= Kerja dalam berbagai bentuk ( Wout – Win )
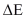 = Perubahan Energi total dari
sistem, ( E2 – E1 )
= Perubahan Energi total dari
sistem, ( E2 – E1 )
Perubahan Energi total 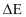 dinyatakan sebagai jumlah dari
perubahan energi dalam
dinyatakan sebagai jumlah dari
perubahan energi dalam 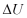 , energi potensial
, energi potensial 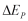 , dan energi kinetik
, dan energi kinetik 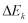 pada suatu sistem, maka persamaan (9)
dapat ditulis dalam bentuk :
pada suatu sistem, maka persamaan (9)
dapat ditulis dalam bentuk :
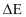 dinyatakan sebagai jumlah dari
perubahan energi dalam
dinyatakan sebagai jumlah dari
perubahan energi dalam 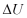 , energi potensial
, energi potensial 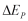 , dan energi kinetik
, dan energi kinetik 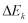 pada suatu sistem, maka persamaan (9)
dapat ditulis dalam bentuk :
pada suatu sistem, maka persamaan (9)
dapat ditulis dalam bentuk :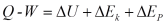 (10)
(10)
Keterangan :
kebanyakan sistem tertutup adalah
stasioner sehingga perubahan energi kinetik dan potensial dapat diabaikan,
persamaan (10) menjadi :
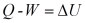 (11)
(11)
Telah menjadi suatu kesepakatan umum,
bahwa tanda “ + “ dan “ – “ dari nilai Q dan W adalah
seperti berikut ini.
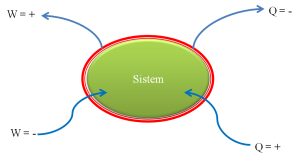
Gambar 4. Sistem tertutup dan notasi kerja dan
panas
Untuk menghitung nilai Kerja (W)
dari suatu proses pada sistem tertutup ini, akan diilustrasikan dari pergerakan
piston di dalam sebuah silinder, seperti gambar berikut ini.
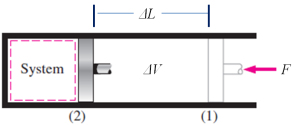
ENERGY
BALANCE FOR CLOSED SYSTEM
Hubungan
energi keseimbangan (atau hukum pertama) yang telah diberikan bersifat intuitif
dan mudah digunakan saat besaran dan arah perpindahan panas dan kerja
diketahui. Hukum pertama
termodinamika tidak lain adalah hukum kekekalan energi (conservation of energy).
Hukum ini menyatakan bahwa: “energi tidak bisa diciptakan dan tidak pula bisa
dimusnahkan dalam sebuah proses; ia hanya bisa berubah bentuk.” Hukum pertama
termodinamika bisa pula dinyatakan dalam formulasi “energy balance” sebagai
berikut:

Ein – Eout biasa disebut sebagai net energy transfer.
Transfer energi bisa dilakukan melalui 3 cara:
Heat transfer Q
Work transfer W
Mass flow
Khusus untuk sistem tertutup, transfer energi hanya
bisa dilakukan melalui cara 1 dan 2 (heat transfer dan work transfer saja).
Adapun untuk control volume, transfer energi bisa dilakukan dengan ketiga cara
diatas.
Dengan demikian, formulasi energy balance diatas bisa
dijabarkan sebagai berikut:

Dalam bentuk rate, formulasi energy balance diatas
bisa dinyatakan sebagai berikut:

Pada kondisi steady state, (dE)system/dt = 0 sehingga:

Pada sistem tertutup, dikarenakan tidak ada transfer
energi akibat mass flow, maka persamaan energy balance tereduksi
menjadi:
Qnet – W net = (dE)system
dimana:
Qnet = Qin – Qout
Wnet = Win – Wout
Pada sebuah siklus (proses yang membentuk kurva
tertutup), (dE)system adalah nol, sehingga Qnet = Wnet.



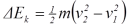
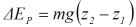

Tidak ada komentar:
Posting Komentar